薬理作用・毒性の基本形式
興奮作用と抑制作用
生体の機能を増強させる作用を「興奮作用」、逆に減弱させる作用を「抑制作用」といいます。
例えば強心薬は、もともとの心臓の機能を増強させますし、鎮静薬は中枢に作用して意識レベルを減弱させることになります。血中濃度が減ってくれば、増強あるいは減弱できた作用は徐々になくなり、最終的に元に戻ります。
期待した作用を維持するためには、薬の反復的な投与が必要になります。
直接作用と間接作用
薬が作用してその器官の働きを変化させる作用を「直接作用」、別の器官の働きを変化させた結果として、それ以外の器官の働きが影響を受ける作用を「間接作用」といいます。
局所作用と全身作用
薬の投与法によって作用するポイントが変わります。
ほとんどの投与方法では程度の差こそあれ全身循環にのり、全身臓器に運ばれるため「全身作用」を引き起こします。一方で、塗り薬のように局所投与する薬の作用は、局所の部分のみの作用に留まるため「局所作用」になります。
注意するポイントとしては「局所作用」を期待する薬でも、血管まで浸透し結果「全身作用」する可能性もあるため、薬を使う前に ADME をを知っておく必要がありますね。
選択毒性
特定の生物によって致命的な毒性を発揮することをいいます。
たとえば「駆虫薬」は特定の寄生虫にのみ毒性を発揮するので、犬や猫の細胞には毒性はありません。ただ、薬物なので「代謝」や「排泄」を受けて、徐々に消失していくことに留意しましょう。
遅発性毒性
「遅発性毒性」とは、薬物の投与から「潜伏期間」を経てから毒性が現れることをいいます。
蓄積作用
単回では大きな影響がないものの、複数回の反復投与によって組織に 蓄積 し副作用として現れることを「蓄積作用」といいます。
一般に脂溶性の薬物は蓄積性が高いとされています。

脂肪量が多い個体では、蓄積しやすいみたい、、、
肥満は良くないね!
毒性の可逆性
薬物による作用は一般的に「可逆性」なので、薬物の「消失」にともなってその作用もなくなっていきます。
中には組織に影響を与えるような化学物質も発見されており、
肝臓や消化管などの再生力のある組織では、その回復力で可逆的である一方で、神経などの回復力が乏しい組織では「不可逆的」になります。
奇形や発がん性が生じるような遺伝子変異が起こるとき、その修復過程で除去された場合は「可逆的」になりますし、除去できず固定された場合は「不可逆的」になります。

遺伝子の修復過程は沢山あるよね!
異常な細胞は「アポトーシス」が誘導されるしね!
耐性と依存性
「耐性」とは、以前に同様のあるいは同類の薬物に曝露されていたことによって、その毒性が減弱することをいいます。
ほとんどの場合、標的組織に到達する薬物量が減少することによって生じています。

有利に働く場合もあれば、不利に働くことがある作用だね、、、
「依存性」とは、薬物の作用の結果、生体に「1:精神的 依存」や「2:身体的 依存」を引き起こすことをいいます。
「1:精神的依存」の場合は 投与する欲求に耐えきれず、
「2:身体的依存」の場合は、「退薬 症状(離脱 症状)」から逃れるために繰り返し摂取することになります。
1:精神的 依存 をもつ薬物
- 大麻
- コカイン
- アンフェタミン(覚醒剤)
2:身体的 依存 をもつ薬物
- アルコール
- フェンタニル
- モルヒネ
- バルビツール酸誘導体
薬理作用・毒性の発現機構
薬理作用・毒性を規定する要因
用量
容量に関わる用語
投与濃度を例えば 0.1 、1、10、100、1000 mg/kg のように段階的に投与した場合に、それぞれの濃度でどの程度の実験動物に治療反応が見られたかを図に表すと以下のようなシグモイド曲線が得られます。
これを「(対数)用量 反応曲線」といいます。

すべての動物で治療反応が得られたときが 100% だね!
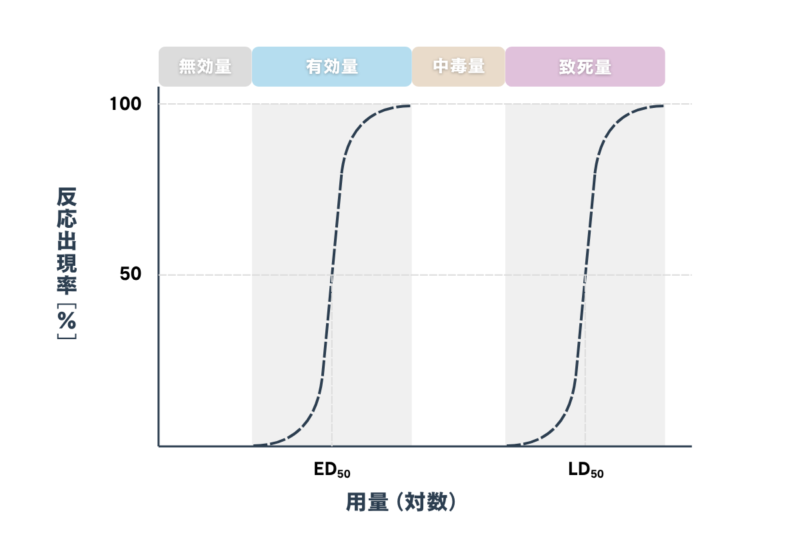

左右の曲線では、縦軸の意味合いが異なる点に注意してね!
有効量の場合は治療反応を示した個体割合、致死量の場合は致死反応を示した個体割合だよ!
薬物が有効な治療効果を示す「有効量」のうち、50%の動物で治療効果が得られる量を「50% 有効量〈 ED50 〉」、また死に至らしめる量のうち、50%の動物が死に至る量を「50% 致死量〈 LD50 〉」といいます。
治療効果が得られるのに必要な薬の用量が少ないほど、すなわち「50% 有効量〈ED50〉」が小さい薬ほど、効果が大きい薬といえます。同様に「50% 致死量〈LD50〉」が小さいほど、死に至らしめる毒性が大きい薬となります。

ちなみに、
LD50の値によって、「毒物」「劇物」「普通の薬物」という分類が決まっているんだよ!
この「LD50」「LD50」を用いることで、
薬の「治療係数( 安全域 )」= LD50/ED50 を算出することが可能です。
「LD50」と「ED50」に差が狭い、すなわち「安全域」が狭い薬とは、「有効量」と「中毒量」や「致死量」が被ってしまう状況を表しています。

わかりやすい状況としては、
治療効果を示す濃度で、副作用も出るってことだね!
似た用語で「50% 致死 濃度〈 LC50 〉」がありますが、
短時間の”吸入”暴露によって50%の動物が死に至る濃度をいいます。
毒性評価の指標
ADI と TDI
食品の生産・製造過程で意図的に使用される物質、たとえば食品添加物は、毎日のように摂取する可能性があります。
このような物質に対して、”一生涯 毎日”摂取しても健康への毒性がない とされる一日あたりの摂取量のことを「ADI(一日摂取許容量)」といいます。
また、意図していないにもかかわらず食品にやむなく混入する物質、たとえば重金属やカビ毒に関しては、「TDI(耐容一日摂取量)」が用いられます。
「ADI(一日摂取許容量)」は以下の計算によって求められます。
ADI = NOAEL / 安全 係数
TDI = NOAEL / 不確実 係数

ちなみにリスク評価を行うのは「食品安全委員会」だよね!
「無 毒性量〈 NO AEL 〉」を求めるために使用しているのは実験動物なので、その数値を人間に適応するのは安全とはいえません。また、同じ人間であっても個体差が生じる可能性があります。
上記の2点を考慮して「安全係数」は 10 × 10の 100 となっています。
抗生物質に関与した容量
抗生物質に関与した容量
一般に MIC < MBC となりますが、
この差が大きければ増殖を抑えられるけど殺菌はできない、いわゆる「静菌的」な抗生物質になります。

このような抗生物質は、耐性菌を生み出しやすいから注意が必要だよね!
MIC ≒ MBC だった場合は、
発育の阻止と同時に殺菌ができるので「殺菌的」な抗生物質になります。
吸入麻酔薬に関与した容量
麻酔薬の記事で解説しますね!少々お待ち下さい!
適用法
薬物の全身投与の方法には「経口投与」と「”非”経口投与(注射投与)」の2つがあります。
| 注射法 | 作用の発現 | 投与量 | 作用の持続 |
|---|---|---|---|
| 経口 投与 | 最も遅い | 最も多い | 最も長い |
| 皮下 投与 | ↓ | ↓ | ↓ |
| 筋肉内 投与 | ↓ | ↓ | ↓ |
| 静脈内 投与 | 最も早い | 最も少ない | 最も短い |
「経口投与」は消化管からの「吸収」、さらには肝臓からの「初回通過効果」も受けるため、発現までの時間や投与量も多くなります。
相互作用
2種類の薬物を併用したとき、
それぞれの薬物のどちらか、あるいは両方の作用が増強する場合を「協力 作用」、減弱する場合を「拮抗 作用」といいます。
「拮抗 作用」に関しては、「競合型 拮抗」と「”非“競合型 拮抗」に分けられています。
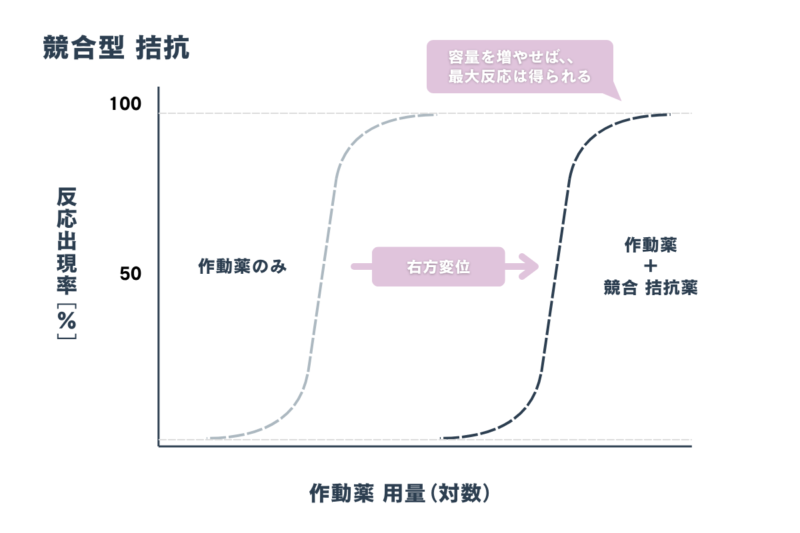
「競合型 拮抗」とは、同一の結合部位を取り合うようにお互いに拮抗します。いわばイス取り合戦なので、それぞれの濃度によって生じる作用は変わります。
①作動薬のみ
②作動薬+競合拮抗薬
とすると、①で最大反応を得られた濃度であっても②では反応が得られません。「競合型 拮抗」においては単に右方に平行移動しているだけなので、作動薬の容量を増やしていけば、いずれ最大反応を得ることが可能です。
「競合型 拮抗」の強さの指標を「pA₂ 値」といいます。「pA₂ 値」が大きいほど、強い競合拮抗薬であるといえます。
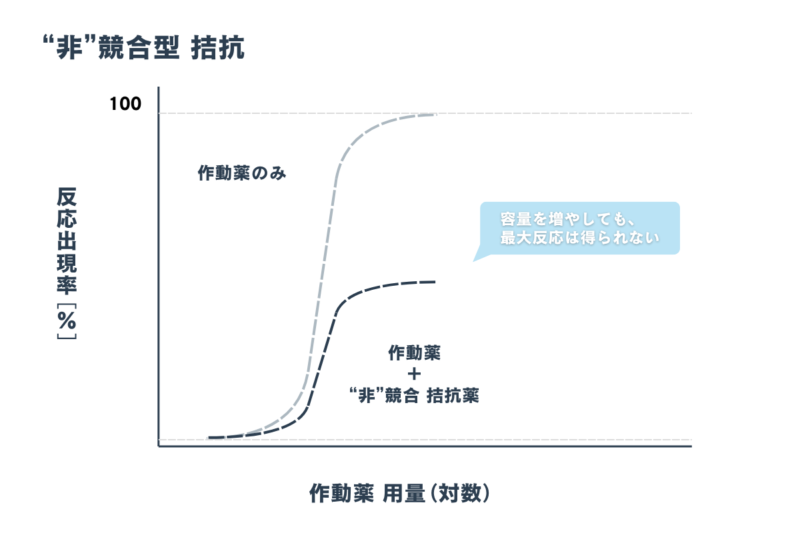
一方で「”非“競合型 拮抗」は、異なる作用点に作用、あるいは受容体へ”非”可逆的に結合します。重要なのは、容量を増やしても元の最大反応は得られません。
「”非”競合型 拮抗」の強さの指標を「pD’₂ 値」といいます。「pD’₂ 値」が大きいほど、強い”非”競合拮抗薬であるといえます。
薬物に対する感受性に関して誤っているのはどれか。
- 新生児は薬の感受性が高い。
- ラットの場合、オスの方が薬物代謝酵素の活性が高い。
- 種差、個体差や系統差には遺伝的因子が関与している。
- 薬に対する感受性に個体差はあるが、種差はない。
- 栄養状態や食餌の影響などの環境因子も関与している。
4が正解です。
新生児は薬の感受性が高い。
ラットの場合、オスの方が薬物代謝酵素の活性が高い。
一般的に性差はないと言われていますが、ラットの場合は少し特殊です。
種差、個体差や系統差には遺伝的因子が関与している。
薬に対する感受性には個体差も種差もある。
栄養状態や食餌の影響などの環境因子も関与している。
薬効の評価
前臨床試験
新薬の薬効や安全性を動物を用いて検証するのが「前 臨床試験(”非”臨床試験)」です。
行われる内容は「薬理 試験」「薬物動態 試験」「安全性 試験」になります。
臨床試験〈1相~4相〉
「前 臨床試験」で確かな薬効と安全性が確認された新薬を、今度は人を用いて検証するのが3相で構成された「臨床試験」です。
| 人数 | 対象 | |
|---|---|---|
| 第Ⅰ相 試験 | 少数 | 健常人 |
| 第Ⅱ相 試験 | 少数 | 患者 |
| 第Ⅲ相 試験 | 多数 | 患者 |
「第Ⅲ相 試験」をクリアした被験薬は、厚生労働省(動物薬なら農林水産省)に申請され、承認がおりると販売・使用されます。
被験薬が市販された後、さらに多くの患者で利用されることによって有効性や安全性に変化があることを考慮して、一定期間後に再検査を受けます。これを「第Ⅳ相 試験」といいます。「医薬品市販後調査」とも呼ばれます。
生物学的検定法
薬物を含めた化学物質は、測定機器を用いて物理化学的な性状が分かっても有害性は判断できません。そのため、その化学物質にどの程度の有害性(あるいは有効性)があるかは、実際に生体を用いる必要があります。
このように生体を用いて化学物質の安全性や有効性を検証することを「生物学的 検定法(バイオアッセイ)」と呼びます。

だけど、3Rがあるから無闇に実験動物を使えないのも事実だね、、、
二重盲検法
「第Ⅲ相 試験」では、新薬の安全性、有効性を比較するためにプラセボ薬も使用します。
このとき系統誤差(バイアス)を避けるため、被験者だけでなく試験者(医者)に対しても、どちらの薬物を投与したかを伏せて検証する方法を「二重盲検法」といいます。

唯一どちらを投与したのかを知っているのは第3者だね!
毒性評価
毒性評価をするにあたって、その毒性試験から得られた結果が信頼できるのかどうかが重要になります。
たとえば、比較対照が準備されているかどうか、再現性があるかどうか、偽陽性を排除出来ているかどうかなど、結果の信頼性を担保するために考えることは沢山あります。
そこで、信頼性を担保するために「GLP 制度」が導入されています。
「GLP」とは、各種毒性試験の信頼性を確保するために、守るべきポイントを定めたものをいい、さまざまな国で共通のGLPが適用されています。

毒性試験には
陰性対照(陰性コントロール)や陽性対照(陽性コントロール)を用意しようね!
毒性試験
毒性を評価するために、沢山の試験が待ち構えています。
毒性試験には、被験物質の全体的作用を検出するための「一般 毒性試験」と、特殊な毒性を評価する「特殊 毒性試験」の2つに大きく分けられます。
まずは「一般 毒性試験」にて、
単回投与で急性毒性を、反復投与で亜急性毒性〜慢性毒性を評価します。
「一般 毒性試験」の曝露経路は、経口、”非”経口、注射などがあり、曝露経路と全身毒性の強さは以下のようになります。
静脈内 > 吸入 > 腹腔内 > 皮下 > 筋肉内 > 皮内 > 経口 > 経皮

急性毒性の指標となるのが「LD50」だね!
動物愛護の観点から「最小致死量」が用いられるケースもあるよ!
「特殊 毒性試験」は「一般 毒性試験」では評価できない特定の毒性作用を評価するための試験です。
毒性試験の概要
毒性評価の指標
毒性評価の指標は、以下にまとめました。
毒性評価の指標
「無 影響量〈 NO EL 〉」は有害・無害にかかわらず、何かしらの影響がある場合の容量なので、「無 毒性量〈 NO AEL 〉」と同じか、それより低い値になります。
また、「無 毒性量〈 NO AEL 〉」を求められなかった場合は、「ベンチマークドーズ」が利用されます。
安全性 薬理試験
「安全性 薬理試験」は、被験薬が、被験者や患者に引き起こす有害作用を検討し、その濃度や機序を解明する毒性試験です。
特に生命の維持に必要不可欠な ①中枢神経系 ②心血管系 ③呼吸器系 の3つの組織にどの程度の影響を示すかを、臨床試験を行う以前に in vivo あるいは in vitro の試験系で行うことを「コア バッテリー試験」といいます。

コアバッテリー試験では生体を用いないんだね!
「コアバッテリー試験」によって有害性が予想された場合には追加の試験項目を評価する「フォローアップ試験」を行い、有害作用を引き起こす濃度やその機序を深堀りしていきます。
また「コアバッテリー試験」で評価していない組織に対して、どのような影響を示すかを評価するために「補足的 安全性 薬理試験」を行う場合もあります。

腎泌尿器系とか胃腸管系とかの影響も気になるよね!
遺伝 毒性試験
遺伝毒性試験は、一つの試験方法ではあらゆる遺伝毒性を検出できないため「標準的バッテリー法」が医薬品の遺伝毒性試験に関するガイドラインで推奨されています。
推奨されているのが赤背景の試験法です。
| 試験 | In vitro(試験管内) | In vivo(生体内) |
|---|---|---|
| DNA損傷 修復検出試験 | コメットアッセイ UDS試験 umn試験 | コメットアッセイ UDS試験 |
| 突然変異試験 | 細菌を用いた復帰突然変異試験 マウスリンフォーマ試験 | トランスジェニックマウス を用いた試験 |
| 染色体異常試験 | 培養細胞を用いた試験 マウスリンフォーマ試験 | 小核試験 |
細菌を用いた復帰突然変異試験で使用されるのが「ネズミチフス菌」「大腸菌」です。
特にネズミチフス菌を用いた試験を「Ames試験」といいます。
培養細胞を用いた試験で使用されるのが、「チャイニーズハムスター細胞株」「ヒト末梢血リンパ球」があります。

ネズミチフス菌を使用するのは一つだけなの?

umu 試験とAmes試験の2つがあるよ!!!これ、いずれ国家試験に出そうだよね。。。






